Se practican comúnmente tres métodos para la prevención de la formación de hidratos en los ductos, y facilidades de producción. Estos son:
- Mantener la T, y P del sistema fuera de la región de formación de hidratos.
- Deshidratar el gas para remover el vapor de agua.
- Inhibir la formación de los hidratos con inhibidores químicos.
La opción 3 se usa comúnmente cuando es impráctico o no económico la instalación de las facilidades de deshidratación, típicamente logrado con el glicol.
Existen una serie de químicas aplicables para la inhibición de los hidratos, pero estos generalmente se ubican dentro de dos tipos: inhibidores de equilibrio (a veces llamados termodinámicos), o cinéticos. Los de equilibrio reducen el estado de equilibrio del punto de formación de hidratos, e incluyen químicas polares tales como los alcoholes, glicoles, y sales. Inhibidores químicos (comúnmente identificados como los inhibidores de baja dosificación, LDHIs) no cambian la condición de equilibrio de los hidratos pero en vez modifican la tasa a la cual se forman los hidratos, o la habilidad de los cristales para aglomerarse en un tapón que pudiése obstaculizar el flujo. Estos no serán discutidos en este artículo, y mayor detalle se podrá obtener de los previos del mes de Junio y Julio.
Los inhibidores de uso más común usados en los sectores aguas arriba, y los de mediana ubicación en la industria del petróleo y gas son: monoetilen o dietilen glicol ( MEG, o DEG), y el metanol. En general, los glicoles se usan comúnmente en sistemas que requieren la inhibición continua. Típicamente, el glicol se recupera, regenera, y es recirculado. Metanol se aplican con mayor frecuencia en los sistemas que no requieren inhibición continua, e.i. sistemas que solo requieren inhibición durante estaciones frías, o en ocasiones de alteración en el proceso. Adicionalmente, el metanol no se recupera para su uso seguido. Esto se debe a la dificultad de separación del metanol del agua. Obviamente existen excepciones a esta regla, ya que el metanol se aplican como inhibidor continuo en algunas instalaciones costa afuera, y en algunas facilidades de procesamiento del gas. Otra desventaja significativa del metanol relativo al glicol, son las altas pérdidas del metanol a las fases de liquido y vapor.
El propósito de este artículo es de revisar la data VLE (EF) para los sistemas metanol-hidrocarburos, y presentar correlaciones que se puedan utilizar para estimar las pérdidas de metanol a la fase de vapor.
La tasa total de inyección requerida para inhibir la formación de hidratos es la suma del inhibidor en la fase acuosa (agua) mas el inhibidor en la fase de vapor y el mismo en la fase líquida, si esta existe.
Como explicado en el Capítulo 6, Volumen 1 de la Referencia [1], las ecuaciones Hammerschmidt [2], Nielsen, y Bucklin [3], o Maddox, et al. [4] pueden aplicarse para estimar el porcentaje de peso del metanol o glicol en las soluciones ricas (fase acuosa) requerida para inhibir la formación de hidratos. La tasa actual de inyección del inhibidor para satisfacer la concentración del mismo en la fase acuosa se determina por balance de masas y es función de la cantidad de agua a ser inhibida, asi como la concentración del inhibidor pobre.
La Figura 6.20 en la página 191 de la referencia [1] proporciona estimados confiables para las pérdidas por vaporización a presiones mejor que aproximadamente 4830 kPa (700 lpca), y concentraciones de metanol en la fase acuosa menor que unos 40%. A presiones mas altas las pérdidas de metanol a l fase de vapor pueden ser significativamente mayores que lo indicado en la Figura 6.20, particularmente en concentraciones altas para el metanol.
En este previo del mes (PDM), revisitaremos la Figura 6.20 de la referencia [1] que indica las pérdidas de metanol a la fase de vapor empleando datos experimentales de equilibrio vapor – líquido reportados en la Boletín de Investigación 117 (GPA RR 117) de la Asociación de Procesadores de Gas. El objetivo de este PDM es reproducir el mismo diagrama cubriendo mayores rangos de presión, temperatura, y porcentaje de peso del metanol en la fase acuosa. Primero demostraremos la certeza del ProMax [6], y luego la versión polar de la ecución de estado Peng Robinson [7] del mismo conjunto de programas de computación (software) para generar la data requerida. Finalmente, para la facilidad de uso los resultados se presentan en forma gráfica.
Resultados y Discusión:
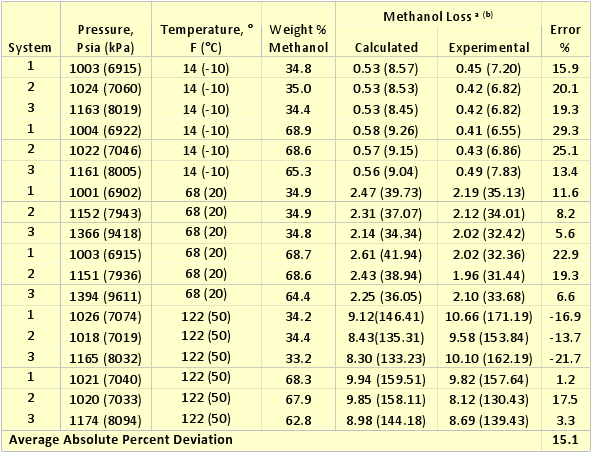
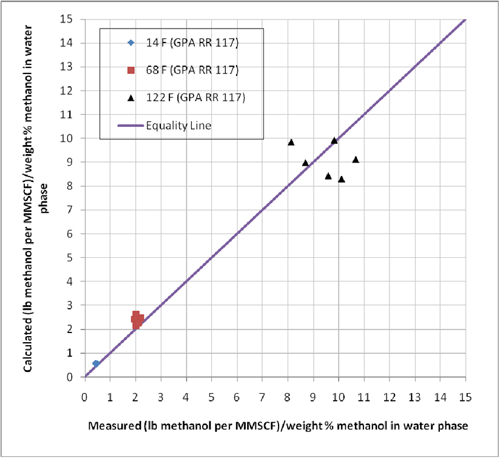
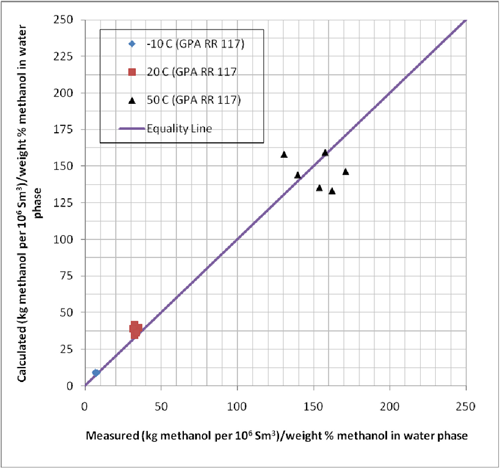
La GPA && 117 presenta composiciones experimentales del equilibrio de fases para los sistemas conteniendo n-heptano, metano, metilciclohexano (MCH), y etano-tolueno en presencia de metanol en concentraciones de 35 , y 70 % de peso con metanol. Las condiciones experimentales para esta data se presentan en la Tabla 1. Para poder evaluar la certeza del sistema de computación ProMax en estos sistemas, hemos pronosticado la razón de concentración del vapor a liquido en términos de lbm de metanol por MMPCS/(% de peso del metanol en la fase acuosa) o kg de metanol por 106 m3std/(% de peso del metanol en la fase acuosa). Los resultados de esta comparación se muestran en la Tabla 1. Las mismas composiciones se indican en forma grafica en las Figuras 1, y 2.
La Tabla 1 indica que el porcentaje absoluto de desviación para los 18 casos probados es aproximadamente 15% con una máxima desviación de 23%. Considerando el hecho que la data experimental posee algún error inherente y con algo de esparcimiento de ésta, la certeza de ProMax es razonablemente buena para la determinación de las pérdidas de metanol en la fase gaseosa.
Tabla 1. Certeza del ProMax para el cómputo de las pérdidas de metanol a la fase de vapor
- Metano-n-Heptano-Metano-Agua
- Metano-Metilciclohexano-Metanol-Agua
- Metano-Tolueno-Metano-Agua
- (lbm de methanol por MMPCS/(%Peso methanol en fase acuosa)
- (kg de metanol por 106 m3std/(% de Peso del metanol en la fase acuosa)
Figura 1. Comparación de las pérdidas pronosticadas del metanol a la fase de vapor con el ProMax y los valores reportados en el GPA RR 117.
Figura 1 (SI). Comparación de las perdidas de metanol previstas a la fase de vapor por ProMax con los datos experimentales reportados en el GPA RR 117.
Figura 2. Comparación de los datos pronosticados de pérdida de metanol a la fase de vapor por ProMax con datos experimentales reportados en el GPA RR 117.
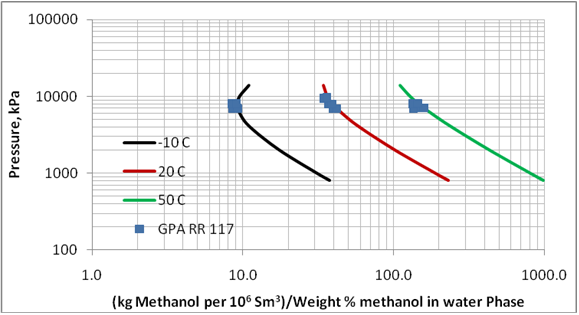
Figura 2 (SI). Comparación de los datos pronosticados de pérdida de metanol a la fase de vapor por ProMax con datos experimentales reportados en el GPA RR 117.
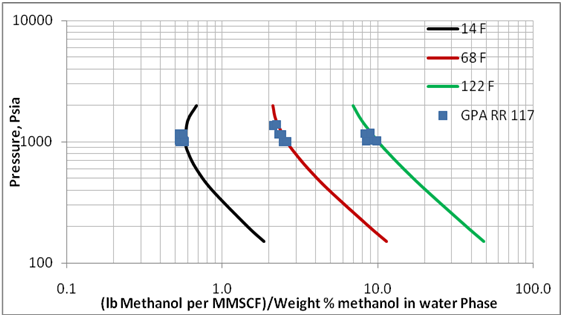
La Figura 3 presenta el efecto de presión y temperatura sobre las pérdidas de metanol a la fase de vapor. Este diagrama es generado para una mezcla con composición total de 33.6 mol% de metano, 22.42 mol% n-heptano, 24.95 Mol% metanol, y 19 mol % agua. Un computo tri-fásico de la mezcla produce, a varias presiones y temperaturas, una fase de vapor de aproximadamente 98% metano, y una fase acuosa conteniendo aproximadamente 70 porciento de peso de metanol. Un diagrama similar fue generado para otra mezcla de composición de 29.43 mol% metano, 19.62 mol%, n-heptano, 11.86 Mol% metanol, and 39.09 mol % agua. La mezcla posterior produce una fase acuosa conteniendo un 35% de peso de metanol. Las pérdidas correspondientes de metanol para estas dos muestras fueron cercanas.
Figura 3. Variación de las pérdidas de metanol a la fase de vapor con presión y temperatura sobre el metanol de concentración de hasta 70 % metanol en fase acuosa
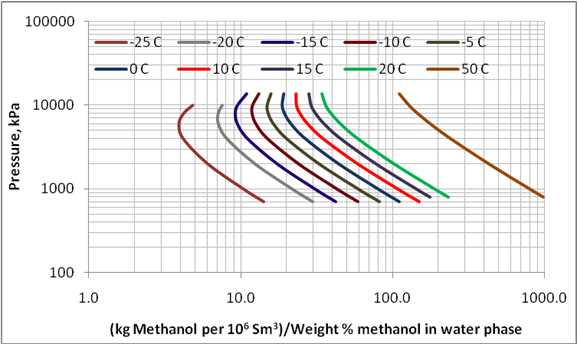
Figura 3 (SI). Variación de las pérdidas de metanol a la fase de vapor con presión y temperatura sobre el metanol de concentración de hasta 70 % metanol en fase acuosa
Conclusión:
Como mostrado en la Tabla 1, y las Figuras 1, y 2, la data experimental limitada del GPA RR 117 indica ProMax puede ser utilizado para estimar las pérdidas de metanol a la fase de vapor. De manera que esta programación de computación fue aplicada para reproducir la Figura 6.20 en la referencia 1, y presentada acá en la Figura 3. Esta figura abarca rangos mayores de presión, temperatura, y porcentaje de peso de metanol ( hasta 70% de peso). Aunque la pérdida de metanol a la fase de vapor indicada en la coordinada – x de la Figura 3 depende de la composición del gas, el efecto de la composición es mínima y puede ser despreciable para los propósitos de planificación y cómputos de facilidades.
Para informarse adicionalmente sobre casos similares y como minimizar los problemas operacionales, sugerimos su asistencia a los eventos de la John M. Campbell ; G4 (Gas Conditioning and Processing) and G5 (Gas Conditioning and Processing-Special).
La consultoría John M. Campbell (JMCC)puede proveer conocimientos termodinámicos para los proyectos de procesamiento de gas para asegurar que el modelo de proceso desarrollado es lo más certero posible. Con los consultores de mayor solicitación en la industria del petróleo y gas, la JMCC suministra su primera selección para los servicios de consultoría para los clientes selectos. Para mayor información sobre los servicios ofrecidos por la Campbell, visite nuestra dirección en la Red al www.jmcampbellconsulting.com
By Dr. Mahmood Moshfeghian
Traducido al Español por: Dr. Frank E. Ashford
Reference:
- Campbell, J. M. “Gas conditioning and processing, Volume 1: Fundamentals,” John M. Campbell and Company, Norman, Oklahoma, USA, 2001.
- Hammerschmidt, E. G., Ind. Engr. Chem., Vol. 26 (1934), p. 851.
- Nielsen, R. B. and R. W. Bucklin, “Why not use methanol for hydrate control?,” Hyd. Proc., Vol. 62, No. 4 (Apr. 1983), p. 71
- Maddox, R.N., M. Moshfeghian, C. H. Tu, A. Shariat, and A. J. Flying “Predicting Hydrate Temperature at High Inhibitor Concentration,” Proceeding of Laurence Reid Gas Conditioning Conference, March 4 – 6, 1991.
- Ng, H. J., Chen, C. J., and D. B. Robinson, D.B.; RR-117, “The Solubility of Methanol or Glycol in Water – Hydrocarbon Systems,” Gas Processors Association (Mar. 1988).
- ProMax 3.1, Bryan Research and Engineering, Inc, Bryan, Texas, 2010.
- Peng, D. Y., and Robinson, D. B., Ind. Eng. Chem. Fundam., Vol. 15, p. 59, 1976.

No comments
Trackbacks
By submitting a comment you grant Campbell Tip of the Month – Spanish a perpetual license to reproduce your words and name/web site in attribution. Inappropriate and irrelevant comments will be removed at an admin’s discretion. Your email is used for verification purposes only, it will never be shared.